التهاب مسري ريه و پرده جنبA060
التهاب مسری ریه و پرده جنب گاو
CONTAGIOUS BOVINE PLEUROPNEUMONIA
PLEUROPNEUMONIE CONTAGIEUSE BOVINE
LUNGSICKNESS
تعریف :
التهاب مسری ریوی - پرده جنبی گاو (CBPP) یا ناخوشی ریوی یک بیماری عفونی(سپتی سمی عفونی) وبشدت مسری باکتریائی با انتشاری آهسته در گاو وگاومیش های آسیائی است که بطور اولیه موجب درگیری ریه ها با تظاهر تقلای تنفسی و گاهی التهاب مفاصل می شود .CBPP یکی از اصلی ترین بیماریهای خطر آفرین مطرح گاوی در آفریقا به شمار می رود . بیماری در دیگر گونه ها همچون گاونر کوهان دار(Yak) ، گاومیش کوهان دارآمریکائی نیز مشاهده شده است. گوسفند ، گاو های وحشی ، شتر ، بز کوهی و بز نسبت به بیماری مقاومت دارند. التهاب مسری ریه و پرده جنب گاو تنها بیماری باکتریائی دسته بندی شده در گروA بیماری های عفونی حاد حیوانات است که توسط سازمان جهانی بهداشت دامی – دفتر بین الملل همه گیری های دامی (OIE) ارائه گردیده. این بیماری قابلیت جدی و سریعی در راستای انتشار بین مرزی دارد و از این رو نتایج اقلیمی – اقتصادی جدی بدنبال داشته و اهمیت اصلی را در تجارت بین المللی دام و محصولات دامی دارد .
تاریخچه بیماری:
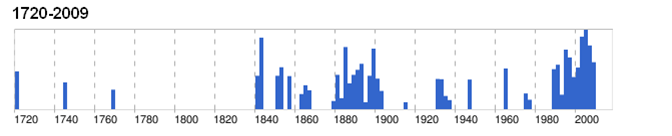
التهاب ریه و پرده جنب گاو یکی از اصلی ترین بیماری های مطرح در قرن نوزده بوده . نخستین مورد گزارش بیماری مربوط به آلمان (1693) بوده که سراسر اروپا را دربرگرفت و با یک گاو شیری مبتلا به آمریکا رسید . تلاش ها به منظور قانونمند نمودن اقدامات کنترلی و محدود سازی بیماری در انگلستان همگی با شکست مواجه شده بود تا اینکه در سال 1869 سند بیماری های مسری به تصویب رسید وبیماری التهاب ریه و پرده جنبی گاو در لیست بیماری های مسری قرار گرفت . مقرارات بیشتری در رده حیوانات به سال 1875 تدوین گردید که مستلزم اعمال محدودیت در حیوانات مبتلا ، کشتار اجباری حیوانات بیماری در قبال پرداخت غرامت به صاحبان آنها و ضد عفونی کردن متعلقات دامداری بود . مایه کوبی های متناوب مورد توجه قرار گرفت ولی مطرود گردید . گزارش های سازمان های دامپزشکی در سال 1876 نشان داد که مایه کوبی بر علیه بیماری ایمنیتی قاطع و مطلق فراهم نمی سازد . گاهی سیاست های کشتاری با موفقیت همراه بوده . در سال 1884 بیماری در آمریکا فراگیر شد . تلاش های سازمان دهی شده در سال 1884 بر علیه بیماری های دامی آغاز گردید، زمانی که کنگره آمریکا یک سرویس ویژه ای را بنام USDA به منظور مبارزه با بیماری التهاب ریه و پرده جنب مسری گاو تاسیس نمود .در سال 1887 اقدامات قرنطینه و کشتار دام های بیمار آغاز شد که به ریشه کنی بیماری در سال 1893 از آمریکا منجر شد. به سال 1898 در یک بررسی مشابه ادموند نوکارد و امیل راکس از انیستیتو پاستور نشان دادند که عامل بیماری در دسته غیر ویروسی جای دارد . یک همه گیری بیماری به سال 1995 در بوتسوانا گزارش شده . در سال 2003 همه گیری که به درگیری 900000 مورد دامی انجامید در مرز آنگولا –زامبیا گزارش گردید .
سبب شناسی بیماری:
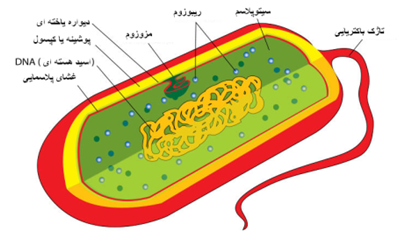
عامل بیماری باکتری یا بعبارتی ریزجانداری است از خانواده مایکوپلاسماتاسه به نام مایکوپلاسما میکوئیدس از تحت گونه میکوئیدس(Mmymysc) که موجب رویش پرکنه های کوچکی (SC) در محیط کشت اختصاصی آن می شود(زیست گونه گاوی ). نوع دیگری از این گونه مایکوپلاسمائی نیز موجود است که پرکنه های بزرگتری را تولید می نماید ، گونه اخیر در بزو گوسفند بیماریزا است . این زیست گونه گاوی دست کم دارای دونوع دودمان(اجداد) اصلی است که یکی شامل اشتقاق های اروپائی بوده و دیگری از اشتقاق های آفریقائی متشکل است ، نژاد های دیگری نیز از این زیست گونه در گوسفند و بز گزارش شده .اگر چه این اشتقاق ها به لحاظ پادگنی شبیه نژاد های گاوی هستند ولی به نظر نمی رسد که در گاو بیماریزا باشند ،ولی به هر حال ممکن است که در نشخوار کنندگان کوچک بیماری های دیگری بغیر از CBPP ایجاد کنند.گونه های مایکوپلاسما از کوچکترین ریزجانداران خود تکثیر شونده ای هستند که در سیاره ما شناخته شده اند . ژنوم این ریزجانداران از 580000 جفت باز (برای Mycoplasma genitalium ) گرفته تا 1358000 جفت باز(برای Mycoplasma penetrans ) متغییر است . این جرم بیماری زا (زیست گونه گاوی) دارای ژنومی حلقوی متشکل از 1211703 جفت بازبوده و محتوای G+C آن 24 درصد می باشد .این ژنوم حاوی مقادیر زیادی از سری های تکراری طویل می باشد . سری کامل ژنومی جفت شده آن اخیراً ساخته شده که شامل 985 ژن مورد قبول است. داشتن یک چنین ژنوم کوچکی گونه های مایکوپلاسمائی را به منابع ژنتیکی و ذخایر تولید کننده زیستی اساساً اقتصادی مبدل می کند. برخلاف دیگر باکتری های بیماری زا که حدت باکتری اساساً بواسطه سموم ، ترکیبات متلاشی کننده یاخته ای و مواد مخرب آنها تعین می گردد ، یک چنین ژن های حدت زای اولیه ای بطور معمول در ژنوم هیچ کدام از 10 نوع مایکوپلاسمای شناخته شده مشخص نگردیده . به نظر می آید که مایکو پلاسما ها از قابلیت های سوخت و سازی ذاتی به منظور ایجاد بیماری در میزبان های حساس و حفظ بقای میکروبی استفاده می کنند . اساساً مایکوپلاسما ها برخلاف دیگرباکتریها فاقد دیواره یاخته ای می باشند که از این رو ریزجاندارانی چندشکلی بوده و نسب به ترکیبات پادزیستی گروه بتالاکتامین مقاوم هستند . رویش مایکوپلاسما ها در محیط های کشت نسبتاً دشوار بوده و نیاز به محیط های ویژه غنی از کلسترول (بعلاوه سرم) دارد . تنها یک نوع پادگنی برای این ریزجاندار بیماریزا(زیست گونه گاوی) شناخته شده . این جرم بیماری زا در محیط پیرامون دوام نداشته و لازمه انتشار آن تماس نزدیک می باشد . ریزجاندار فوق(گونه ریز پرکنه) تنها در بدن موجود زنده پایدار بوده و در محیط خارج به سرعت غیرفعال می گردد. در محلول های نمکی با دمای 45 درجه سانتی گراد در طی 120 دقیقه ویا با دمای 47 درجه سانتی گراد در طی 2 دقیقه غیر فعال می شود ، در لنف با دمای 45 درجه سانتی گراد در طی 240 دقیقه ویا با دمای 60 درجه سانتی گراد در طی 2 دقیقه غیر فعال می شود. این جرم بیماری زا نسبت به PH اسیدی و قلیائی حساس بوده و توسط اتر ، کلرید جیوه 01/0 درصد ، هیدرواکسید کلسیم ، فنل 1 درصد(در طی 3 دقیقه) و محلول فرم آلدئید 5/0 درصد(در طی 30 ثانیه) نابود می گردد . این زیست گونه گاوی به خوبی در بافت های یخ زده پایدار است ولی تحت شرایط معمول محیطی در گوشت و محصولات گوشتی بیش از چند روز دوام نمی آورد .
همه گیر شناسی:
چنانکه اشاره گردید عامل بیماریزا (Mmymysc) در شرایط محیطی قابلیت زیستی نداشته و تحت تاثیر ترکیبات ضد عفونی کننده ، حرارت وخشکی غیرفعال می گردد. بیماری عموماً در گاو(Bos taurus)، گاومیش آبی(Bubalus bubalis) و گاوهای زبو(Bos indicus) پدیدار می شود اگرچه موارد نادری از وقوع طبیعی بیماری را می توان در گاو نر کوهان دار( Bos grunnien) ، گاومیش کوهان دار آمریکائی (Bison bison ) ، گوزن شمالی، و بزکوهی مشاهده نمود . علارغم اینکه گاومیش های اهلی نسبت به بیماری حساس هستند ولی ایجاد تجربی بیماری دراین نوع دام دشوار است. اساساً نژادهای اروپائی گاو حساس تر از نژادهای آفریقائی هستند . ولی در گاوهای وحشی و شتر بیماری دیده نمی شود . بیماری را می توان بطور تجربی در گاومیش آفریقائی و گوزن دم سفید ایجاد کرد اما در گونه های وحش دیده نمی شود، از این رو به نظر نمی رسد که این گونه های وحش نقشی را درهمه گیری بیماری داشته باشند . با تزریق عامل بیماری زای( زیست گونه گاوی) حاصله از کشت به گوسفند و بز یک سلولیت موضعی بدون بروز اختلالی در ریه پدیدا می شود . پس از بروز بیماری ایمنیتی قوی در گاو حاصل می آید و طرح های مایه کوبی نقش مهمی را در کنترل بیماری دارند . پاسخ های ایمنی در نژاد های بوس تاروس و بوس ایندیکوس یکسان است . به نظر می رسد که برخی سنین نسبت به بیماری مقاوم هستند ، حیوانات کمتر از 3 سال سن مقاومت کمتری در برابرآلودگی های تجربی ند . اصلی ترین شیوه انتشار بیماری بواسطه استنشاق قطرات آلوده به عامل بیماریزا است که از بیماران فعال یا ناقلین بیماری ناشی شده و در واقع جرم بیماری زا توسط سرفه ، بزاق ، ادرار و دیگر ترشحات آلوده دامی منتقل می گردد.ریزجاندار فوق را می توان در بزاق ، ادرار، پرده های جنینی و ترشحات رحمی یافت . در تحت شرایط طبیعی ایجاد عفونت واسطه ای توسط اشیای بیجان آلوده یکی از راه های غیرمحتمل در انتشار بیماری است ، ولی بطور تجربی می توان با استفاده از علوفه آلوده تا 144 ساعت آن را محقق کرد . دیگر اشیای بی جان همچون جفت و ادرار نیز می توانند بطور درازمدت عفونی بمانند . عفونت جفت گذر ممکن بوده و ناقلین به ظاهر سالم منبع اصلی انتشار عامل بیماری زا هستند . دامهای ناقل شامل آن دسته از گاوهایی هستند که بصورت تحت بالینی آلوده می باشند ، این ناقلین عامل بیماری را در ضایعات کپسوله شده ریوی (بافت های مرده) تا دو سال نیز بطور زنده نگاه می دارند و در تحت شرایط استرسی این عوامل را رها می سازند ، همچنین نقل و انتقال گاو ها در انتشار بیماری حائز اهمیت است. با توجه به شیوه انتشار بیماری وقوع آن بیشتر محدود به حیواناتی است که در سیستم پروش بسته نگهداری شده و یا به جهت حمل و نقل در تماس نزدیک بوده اند . کانون های آلودگی بیماری با حضور دامهای بهبود یافته ناقل تشکیل می گردد ، در این ناقلین بافت های مرده ریوی منبع اصلی انتشار ریزجاندار بیماری زا است که تا 3 سال نیز ممکن است تداوم انتشار داشته باشد . اعتقاد محققین بر این است که بروز شرایط استرس زا در نتیجه قحطی ، خستگی و فرسودگی و یا حضور یک بیماری مداخله گر دیگر می تواند موجب شکستن سد بافت مرده ریوی شده و دام را به یک منبع انتشاری فعال تبدیل نماید . تشکیل ضایعات کلیوی در این بیماری غیر معمول نبوده از این رو انتشار گسترده عوامل بیماری توسط ادرار امکان پذیر است ، که خود با پراکنش قطرات ادراری منجر به اشاعه بیماری می گردد . در مناطق خشک ولم یزرع میزان وقوع بیماری کم می باشد چراکه عامل بیماری زا در قطرات خشک شده به سرعت تخریب می شود ولی در مناطق مرطوب (چون اروپا) و باحضور باد های مناسب انتشار قطرات آلوده تسهیل می گردد . اگر چه وجود فاصله 6 متری برای ممانعت از انتشار بیماری کافی به نظر می رسد ولی امکان انتقال بیمار تافاصله 45 متری نیز مقدور می باشد . در مواردی ممکن است که گاو 8 ماه پیش از تثبیت بیماری در تماس با عامل بیماری قرار گرفته باشد (دوره نهفته بیماری معمولاً 3-6 هفته است)، به این جهت پیش از ورود گله جدیدی به منطقه عاری از بیماری بهتر است دامهای خریداری شده مدت طولانی در قرنطینه باشند. از آن جهتی که دوره نهفته بیماری دراز مدت بوده و اشکال تحت حاد و بی نشانی از بیماری ممکن است موجود باشند (حدوداً 20درصد دامهای یک گله مبتلا) خطر انتشار بیماری همواره زیاد است . میزان شیوع و تلفات بیماری به میزان زیادی متغییر است. در گله ای که به بیماری حساس است (فاقد ایمنیت) میزان شیوع بیماری تا 90 درصد بوده و از طرفی میزان تلفات گله ممکن است تا حداکثر 50 درصد برسد . در گله های حساس تلفات ممکن است تا 80 درصد نیز برسد و بسیاری از دام هائی که زنده مانده اند به یک ناقل مزمن تبدیل شده و از یک تب راجعه خفیف ، لاغری و نشانه های تنفسی با شروع تمرینات رنج می برند .به نظر می رسد که نژاد های اروپائی درمقایسه با نژادهائی که منشاء آفریقائی دارند حساس تر می باشند . میزان شیوع با بسته بودن سیستم پرورشی افزایش می یابد چراکه در این وضعیت میزان انتشار یشتر است . میزان شیوع بیماری دربرسی های انجام یافته در آفریقا نشان می دهد که عوامل ثانویه ای چون تغذیه و آلودگی های انگلی بر آن تاثیر گذارند. در آغاز شیوع بیماری در یک منطقه و گله های آن ناحیه بیماری بصورت حاد ، بانشانه های بالینی شدید و تلفات بالا تظاهر می نماید . با تثبیت بیماری در منطقه از میزان تلفات کاسته شده و شمار دامهای درگیر با شکل مزمن بیماری افزایش می یابد . بسته به نژاد ویروس نیز میزان شیوع و تلفات متفاوت است ، بعنوان مثال در یک تجربه ناشی از نژاد کنیائی دوره نهفته بیماری طولانی بوده (تا 3 ما) میزان شیوع 50 درصد و میزات تلفات 25 درصد گزارش شده در مقابل نژاد کامرونی عامل بیماری زا دوره نهفته کوتاه تری داشته ( 10 تا 40 روز) میزان شیوع 82 درصد و نرخ تلفات 40 درصد بوده . از نظر توزیع جغرافیائی بیماری می توان گفت که CBPP در اغلب بخش های آفریقا بومی شده .در بخش هائی از آسیا ، خصوصاً هندوستان و چین مشکل آفرین است . بیماری بطور دوره ای در اروپا تظاهر داشته و شیوع بیماری در طی دهه اخیر در اسپانیا ، پرتغال و ایتالیا دیده شده . موارد انفرادی از بیماری در خاور میانه گزارش شده که احتمالاً ناشی از نقل و انتقال دام از آفریقا بوده.
روند بیماری زائی:
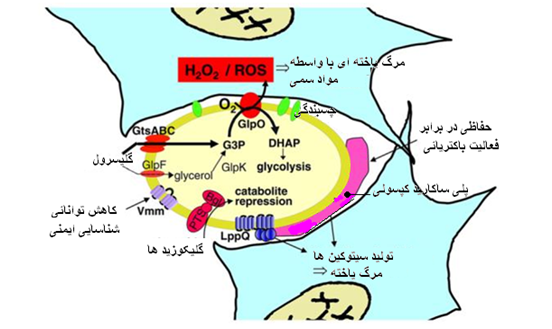
در میان گونه های مایکوپلاسمائی زیست گونه گاوی از بیماری زا ترین گونه ها به شمار می رود. حدت این جرم بیماری زا احتمالاً ناشی از کنش هماهنگ اجزای پادگنی و عملیاتی حاضر در ساختار معماری سطح پویای آن است. ویژگی های حدت زای مختلف به عامل بیماری زا اجازه گریز از دفاع ایمنی میزبان را داده ، آن را به سطح یاخته میزبان چسبانده ، موجب تداوم و انتشار عامل در میزبان شده (انتشار خونی مایکوپلاسما) ، مواد مغذی باارزش موجود در محیط را بدست آورده و با رهایش و جابجائی محصولات سوخت و سازی سمی به یاخته های میزبان موجب بروز تاثیرات سمی می شود بطوری که این تاثیرات با ایجاد روند های التهابی و بیماری مشخص می گردند . این چنین راهکاری مایکوپلاسما را قادر می سازد تا کمترین میزان اطلاعات ژنتیکی را در ژنوم کوچک خود بکار برد،بدین ترتیب نه تنها عملکرد های پایه برای تکثیر بلکه همچنین آسیب به یاخته های میزبان نیز در این مجاورت نزدیک محقق می گردد ، بنابر این ملکول های زیستی همچون اسید های آمینه و اسید های هسته ای ضروری جهت بقاء و تولید ترکیبات زیستی را بدست می آورده . به نظر می رسد که حدت این جرم بیمارزا بواسطه عملکرد های ذاتی ذیل تعین می گردد: 1) کپسول پلی ساکاریدی که ظاهراً در مقاومت سرمی و بروز انعقاد داخل رگی دخیل است . 2) لیپوپروتئین های که آغاز گر سازو کار های بیماری زائی بوده ودر رهایش سیتوکین های پیش التهابی ایفای نقش می نمایند . 3) عامل چسبندگی که تاکنون ناشناخته مانده بطوری که ممکن است نقش مرکزی را در واکنشهای تنگاتنگ عامل بیماری زا با یاخته های میزبان برای یک دوره طولانی بازی کند، چنانکه آبشاری از پیامهای آغاز گر را بوجود می آورد که به یاخته های میزبان منتقل شده و موجب بروز التهاب می شود . 4) عناصر تکراری در پروتئین های غشائی متنوع مایکوپلاسمائی که احتمالاً توانائی چسبندگی عامل بیماری زا به یاخته میزبان و گریز از پاسخ ایمنی میزبان را افزایش می دهد . 5) عوامل تنظیم کننده ایمنی که موجب مرگ درون یاخته ای یاخته های تک هسته ای بواسطه زیست گونه گاوی زنده یا مواد آزاد شده از این زیست گونه می شوند . 6) محصولات جانبی سوخت و سازی سمی همچون آب اکسیژنه(پراکسید هیدروژن) ، بطوری که بصورت موثر به یاخته های میزان منتقل می شوند و موجب مرگ یاخته می شوند . برای ایجاد بیماری یا بعبارتی داشتن حدت ، زیست گونه گاوی دارای سازوکارهای ملکولی متعدد بیماری زا بوده به گونه ای که این سازوکار ها برای جرم بیماری زا این امکان را فراهم می سازند که به بافت خاصی از میزبان متصل شده ، از دفاع ایمنی میزبان بگرزد ، دربدن دام آلوده شده دوام داشته و منتشر گردد ، اثرات سمی بر یاخته های میزبانی داشته و موجب بروز التهاب و ضایعات مربوط به بیماری گردد . فقدان هر کدام از این سازو کار ها منجر به تخفیف حدت یا از بین رفتن آن می گردد . با استنشاق ذرات آلوده به جرم بیماری زا و رسیدن آن به حبابچه های ریوی ، مایکوپلاسما در ابتدا مواجه با سامانه دفاعی ریوی است . این سامانه دفاعی خود متشکل از دوبخش ایمنی ذاتی و ایمنی اکتسابی است . پاسخ ایمنی ذاتی در ریه نه تنها اولین خط دفاعی در برابر روند چسبندگی و تجمع عامل بیماربوده واز ایجاد عفونت نیز ممانعت بعمل می آورد، بلکه تعین کننده پادگن مورد پاسخ ایمنی و طبیعت پاسخ بوجود آمده در مقابل آن است . در مجرای تنفسی سازوکارهای دیگری نیز حضور دارند و مکمل این دفاع ایمنی ذاتی هستند که بافت ریه و مسیر تنفسی را از تجمع و بروز عفونت محافظت می نمایند این سازو کار ها عبارتند از : - سازوکار پاکسازی مخاطی مژه ای که بطور موثر اجرام بیماری زا را از سطوح مخاطی ریه زدوده و توام با پالایش پویای گازی و باز تاب های مسیر هوائی همچون سرفه و عطسه است. - ترشح ترکیبات موکوسی توسط غدد موکوسی و یاخته های جامی مسیر های هوائی بزرگ که سبب بدام افتادن ذرات استنشاق شده گردیده و آنگاه بواسطه حرکات مژه ای دفع می شوند . - اجزای یاخته ای دفاع ایمنی ذاتی ریه شامل یاخته های بیگانه خوار حبابچه ای ،نوتروفیل ها و یاخته های پوششی هستند . یاخته های نام برده نه تنها عملکردی اجرائی در مقابل عامل بیماری زا دارند بلکه همچنین پاسخ ایمنی در برابر عفونت را نیز آغاز کرده و یا هماهنگ می نمایند . - ترشحات مجرای تنفسی حاوی پروتئین ها و ترکیبات پپتیدی است که مستقیماً اجرام بیماری زا را نابود یا مهار نموده ویا اینکه موجب تنظیم پاسخ های ایمنی می شوند . این مولکول ها توسط ابزار ترشحی سامانه تنفسی که شامل غدد و یاخته های جامی مسیر های تنفسی بزرگ ، یاخته های کلارای مسیر های هوائی دور (دیستال) و یاخته های ریوی (پنوموسیت) نوع دوم بافت ریوی است ترشح می گردند . از این ترکیبات که در مایع سطحی مسیر هوائی(ASF) حضور داشته و دارای اثر ضد میکروبی هستند می توان به لیزوزیم، لاکتوفرین ، فسفولیپاز A2 ترشحی و مهار کننده پروتئازی لوکوسیتی (SLPI) اشاره نمود. دیگر مواد همچون ترکیبات کمپلامانی ، پروتئین های سطحی و پروتئین های یاخته های کلارا (CC10,CCSP) نیز در دفاع میزبانی ایفای نقش می نمایند .
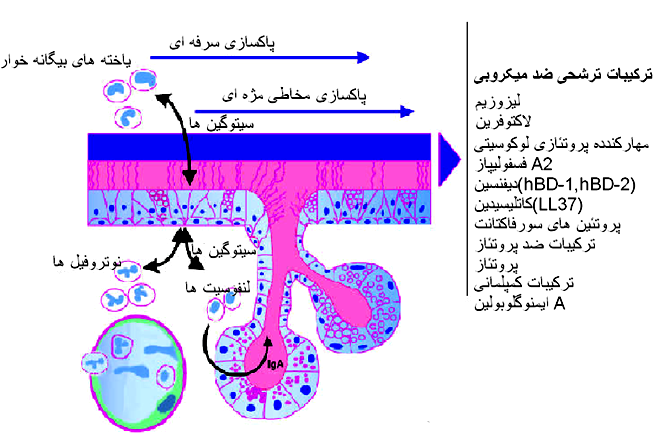
با ورود زیست گونه گاوی به ریه از طریق استنشاقی ذرات آلوده ، در ابتدا میکروب در مواجه با سامانه دفاعی ذاتی ریه قرار می گیرد ( که به آن اشاره گردید) . این نوع ریزجاندار بیماری زا با داشتن کپسول گالاکتان ،لیپو پروتئین های سطحی ولایه اولیگوساکاریدی پیرامون آن که عمدتاً متشکل از تارچک های پلی کربو هیدراتی است (لایه زیستی ) از تاثیر ترکیبات ضد میکروبی موجود در ASF و روند بیگانه خواری در امان بوده وبه نظر می آید که با کمک این لایه های محافظ خود را به سطح یاخته های پوششی مسیر هوائی متصل کرده و تجمع می یابد ، لایه زیستی این میکروب سبب می شود تا این ریزجانداران به یکدیگر نیز متصل شده و ریزپرکنه هایی را بر سطوح مخاطی و اشیای بیجان ایجاد نمایند که غالباً در برابر عوامل ضد باکتریایی میزبان و ترکیبات پادزیستی مقاوم می باشند ، از طرفی این لایه های محافظ اثر سمی داشته و ممکن است موجب بروز پاسخ های خود ایمنی بواسطه تشابه ساختمانی با پنوموگالاکتان گاوی گردند . کپسول پلی ساگاریدی گالاکتان این زیست گونه گاوی متشکل از 6-O-β-d-galactofuranosyl-d-galactose است که در برسی های بعمل آمده ثابت شده حدت این جرم بیماری زا را افزایش می دهد . تزریق داخل ورید ای گالاکتان به گوساله ها موجب بروز یک حبس تنفسی موقت ، افزایش فشار سرخ رگی و ادم ریوی می گردد ، این یافته ها نشان می دهد که کپسول پلی ساکاریدی زیست گونه گاوی تاثیر کشندگی بر یاخته های ریوی داشته و بنظر می آید که سبب بروز انقباض در عروق خونی می شود که خود می تواند موجب پیدایش لخته های خونی (ترمبوز) گردد. اصلی ترین بخش از روند بیماری زائی در این بیماری همان بروز انعقاد داخل عروقی در ریه است که احتمالاً پیش از پیدایش ضایعات ریوی ظاهر می گردد . جرم بیماری زا پس از ایجاد کانون اولیه تهاجمی در بافت ریه و عبور از سد دفاعی اولیه وارد خون شده و ایجاد یک عفونت خونی اولیه(سپتیسمی) می کند . این بیماری در واقع نوعی التهاب حاد ریوی قطعه ای و التهاب پرده های جنبی است، پس از عفونت خونی اولیه در بافت ریه حاصل می شود . با گسترش خونی، میکروب مجدداً به بافت ریه وارد شده و در مجاورت با یاخته های ریوی قرار می گیرد ، پس از چسبیدن به یاخته های فوق و برقراری تماسی نزدیک که لازمه شروع روند بیماری است اثرات سمی خود را بر این یاخته ها اعمال می کند . اصلی ترین سازوکار اعمال سمیت بر یاخته های میزبان با تولید H2O2 محقق می گردد . برای تولید این H2O2 و انتقال آن به داخل یاخته میزبان عامل بیماری زا دارای ابزار ها و سازو کار های ویژه ای است. در غشای مایکوپلاسماها دو سامانه انتقالی خاص وجود دارد که موجب انتقال گلیسرول به داخل جرم بیماری زا می شود یکی بنام جعبه پیوند ATP سامانه انتقال گلیسرولی(GtsABC) ودیگری بنام عامل تسهیل کننده گلیسرول (GlpF) ، نقش GtsABC برداشت گلیسرول و انتقال آن به بداخل مایکوپلاسما است و همزمان با آن عمل فسفوریلاسیون گلیسرول را نیز انجام داده و گلیسرول تری فسفات (G3p) را تولید می کند، GlpF نیز از طرفی موجب انتقال گلیسرول به داخل مایکوپلاسما شده که بدنبال آن توسط آنزیمی بنام گلیسرول کیناز(GlpK) فسفوریله شده و به G3p تبدیل می شود ، گلیسرول تری فسفات های تولید شده در داخل مایکوپلاسما توسط یک پروتئین غشائی مایکوپلاسما بنام (L –α گلیسرو فسفات اکسیداز =GlpO ) که نوعی تسهیل کننده واکنشی است (کاتالیزور) اکسیده شده و تولید دهیدرو اکسی استون فسفات (DHAP) و H2O2 می کنند ، DHAP در روند گلیکولیز مصرف شده و پراکسید هیدروژن های ایجاد شده توسط GlpO به داخل یاخته میزبان منتقل و اثرات سمی را در یاخته اعمال می نمایند . سازو کار دیگری را که می توان بطور غیر مستقیم در بیماری زا بودن مایکوپلاسما های حدت دار دخیل دانست، مربوط به سامانه انتقال فسفر- قند وابسطه به فسفوانول پیروات (PEP-PTS) و آنزیم 6-فسفوبتا گلوکوزیداز(Bgl) می باشد. اساساً دی ساکارید های شبه گلوکوزیدی از مهمترین منابع تامین کننده کربن و انرژی برای باکتری ها هستند این دی ساکارید ها بواسطه سازو کار جابجائی و فسفوریلاسیون توسط سامانه PEP-PTS بصورت مشتقات فسفوریله شده در داخل مایکوپلاسما تجمع یافته و آنگاه توسط آنزیم Bgl تجزیه می شوند .Bgl بطور اختصاصی پیوند بتا گلیکوزیدی میان کربن آنومریک و اکسیژن گلیکوزیدی فسفوبتا دی گلوکوزید ها را هیدرولیز می کند ، در نتیجه این واکنش آنزیمی منوساکاریدهائی حاصل می آیند که بعداً فسفوریله شده و در طی روند سوخت و ساز گلیکولیز یا دیگر واکنش ها همچون اکسیداسیون قند ها مصرف می شوند . در مایکوپلاسما ها اکسیداسیون قند ها به همراه اکسیداسیون اسید های آلی با گلیسرول منجر به تولید پراکسید هیدروژن می شود . تولید پراکسید هیدروژن (H2O2) وابسطه به گلیسرول از شاخص های حدت آفرین برای مایکوپلاسما ها است . برعکس میزان پراکسید هیدروژن تولید شده توسط مایکوپلاسما ها در حضور قند ها 20 بار از آن گلیسرول کمتر است . از طرفی بتا دی گلوکوزید ها تا حدی سرکوبی عوامل حدت آفرین مایکوپلاسما ها را وساطت می کنند . به این سازو کارها اصطلاحاً سرکوب ناشی از محصولات سوخت و سازی کربن (CCR) اطلاق می شود .در غالب باکتری ها آنزیم های دخیل در انتقال و فسفوریلاسیون قند ها نقش اساسی در تولید پیامهائی را دارند که از طریق سازو کارهای هدایتی مختلف منجر به CCR می شود بطوری که ممکن است ژنهای مسئول حدت را به کمترین میزان فعالیت برساند.از طرفی فعالیت آنزیمی Bgl در کنترل رشد مایکوپلاسما ها تاثیر گذار است . سویه هائی که دارای فعالیت آنزیمی ناقص Bgl هستند (ایزوفرم والین 204) در مقایسه با سویه هائی که آنزیم فعال Bgl دارند (ایزوفرم آلانین 204) توانائی بیشتری برای حفظ بقاء در محیط حاوی بتا دی گلوکوزید دارند ، یعنی در واقع با جایگزین شدن اسید آمینه والین بجای آلانین در آنزیم Bgl تغییرات ساختاری حاصل می شود که نتیجه آن غیر فعال شدن آنزیم است ، چون با افزایش سوخت وساز قند ها رشد باکتری ها دچاروقفه می گردد در نتیجه سویه های دارای Bgl فعال در محیط حاوی قند (بدن دام یا گردش خونی) قابلیت کمتری در تداوم زیستی در مقایسه با سویه های دارای Bgl غیر فعال خواهند داشت . این وقفه رشد در محیط قندی خود ناشی از دو سازو کار است . یکی مرگ باکتری و دیگری مهار رشد آن .در سازو کار مرگ باکتری افزایش سرعت گلیکولیز و در نتیجه تولید بیش از حد محصول سمی متیل گلیوکسال موجب مرگ باکتری می شود و در سازو کار مهار رشد باکتری تجمع بیش از اندازه ارگانوفسفا تها در میکروب و یا تخلیه ذخایر فسفات های غیر آلی موجب این مهار رشد می شود . در مایکوپلاسما های دارای Bgl فعال (سویه های تخفیف حدت یافته) بدلیل افزایش سوخت و ساز قندها (بتادی گلوکوزید ها) هر دو ساز و کار مرگ و مهار رشد فعال شده و رشدمایکوپلاسما متوقف می گردد ولی در انواعی که دارای Bgl غیر فعال هستند (سویه های حدت دار) بتا دی گلوکوزید ها در روند های سوخت و سازی مصرف نشده و دو سازو کار مرگ و مهار رشد باکتری غیر فعال است. نتیجه این رخداد ها در سویه های حدت دار این است که سویه های فوق قادرند در بدن میزبان دوام داشته و گسترش یابند . نکته قابل توجه دیگر در روند بیماری زائی ناخوشی دامی فوق این است که بسیاری از مایکوپلاسماها و از جمله این زیست گونه گاوی در سطح خود پروتئین هائی را عرضه می کنند که در تحت تغییرات برگشت پذیر بوده و از این رو موجب تغییر ذخایر پادگنی در سطح میکروب و جمعیت میکروبی می شوند ، نتیجه رخداد فوق ایجاد تطابق پذیری و گریز از دفاع ایمنی میزبان است. تعدادی از این پروتئین های تغییر پذیر در روند چسبیدن و تنظیم ایمنی ایفای نقش می کنند ، در زیست گونه گاوی تنها دونوع از این پروتئین ها تا کنون مشخص شده اند . یکی از این پروتئین های سطحی به نام Vmm نوعی لیپوپروتئین کوچک است (17KDa) ، 14 نوع پروتئین با عملکری مشابه در این زیست گونه شناسائی شده که بعنوان پروتئین های شبه Vmm معروف هستند . در طی روند عفونت این نوع پروتئین ها در سطح میکروب پدیدار شده و امکان فرار میکروب از دفاع ایمنی اکتسابی را فراهم می سازند . با ادامه روند حیات میکروب در داخل بدن میزبان و گریز از دست دفاع ایمنی این ریزجاندار بیماری زا بواسطه اجزای ساختمانی خاصی سبب بروز یک روند خود ایمنی می گردد که تظاهرات آسیب شناختی ویژه این بیماری را بوجود می آورد . اطلاعات اندکی در مورد اجزای ایمنی زای زیست گونه گاوی تا کنون بدست آمده ولی با توجه به برسی های اخیر ثبات شده که یک لیپوپروتئین سطحی به نام P72 (72KDa) موجب بروز پاسخ ایمنی هومورال اولیه و بادوام در گاو های مبتلا به این بیماری می شود . تعدادی از پادگن های ایمنی زای اصلی در سویه های مختلفی از مایکوپلاسما مشخص گردیده . پاسخ های ایمنی نایژکی (IgA) در این بیماری قوی بوده ولی در مقابل تعداد کمی از پادگن ها سرمی ایجاد می شوند و این پادگن ها مربوط به لیپو پروتئین های سطح مایکوپلاسما هستند که در میان آنها غالب ترین پادگن ایمنی زا لیپوپروتئین نوع Q (LppQ) می باشد و در طی روند عفونت در سطح این ریزجاندار بیماری زا ظاهر می شود . تصور بر این است که واکنش های خود ایمنی و ازدیاد حساسیت نقش اساسی در پیدایش ضایعات خاص این بیماری را دارند . اصلی ترن پی آمد عفونت ناشی از این زیست گونه گاوی واکنش های التهابی گسترده و حجیمی است که اساساً محدود به ریه بوده و در اثر تصلب ریوی موجب اختلال تنفسی و نهایتاً مرگ دام می شوند . اصولاً با بروز بیماری تا 30٪ از دامهای به شکل حاد بیماری مبتلا بوده و تلف می شوند ، ولی در بیشتر دامها ، بیماری به شکل مزمن بوده و دام پس از بهبودی بعنوان یک ناقل بالقوه بیماری عمل می نماید. در این نوع از دامهای بهبود یافته پاسخ های سلولی تیموسی ناشی از لنفوسیت های تیموسی یاور نوع یک CD4 به عامل بیماری زا در یک دوره زمانی طولانی تثبیت می گردد ، در حالی که در موارد حاد بیماری گسترش ضایعات بیماری همراه با کاهش توانائی یاخته های تک هسته ای خون محیطی در تولید اینترفرون است . این یافته ها نشانگر آن است که حساسیت گاوها به عفونت با زیست گونه گاوی همراه با تغییر جهت پاسخ های ایمنی به شکلی است که اجازه پراکنش وانتشار به عامل بیماری زا داده و آسیب های ایمنی زا را گسترش می دهد .
نشانه های بالینی:
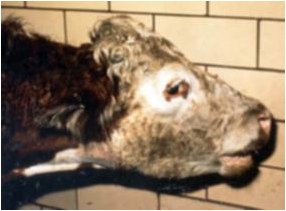
به لحاظ بالینی تمیز التهاب مسری ریه و پرده جنب گاو از دیگر بیماری های تنفسی در این دام دشوار می باشد .این بیماری در گله با نشانه های التهاب ریوی (خصوصاً بصورت بیماری یک طرفی ) در بالغین و التهاب مفصلی چند گانه در گوساله ها تظاهر می کند . سویه های آفریقائی عامل بیماری زا موجب بروز شکل شدیدی از بیماری شده در حالی که در همه گیری های اخیر اروپا بیماری بصورت ملایم تری تظاهر نموده . دوره نهفته بیماری از 3 هفته تا 3 ماه متغییر می باشد . با تلقیح تجربی عامل بیماری زا در نای نشانه های بالینی 2تا 3 هفته بعد پدیدار می گردند. در طی یک همه گیری طبیعی تنها 33 درصد از دامها ضایعه دار بود (اشکال فوق حاد و حاد)، 46 درصد دچار عفونت شده ولی ضایعه ای را نشان نمی دهند و 21 درصد مقاوم به نظر می رسند . نشانه های بالینی را باتوجه به سن دام(بالغین و گوساله ها ) می تواند تفکیک کرد . در بالغین تب به همراه ضایعات ریوی و پرده جنبی مشهود است این ضایعات با افزایش سرعت تنفسی ، حالت کماری خاص خود(آرنج ها به سمت خارج، پشت قوز کرده، سرکشیده)، سرفه (در ابتدا خشک ، مختصر و غیر حمله ای بوده ، مرطوب می شود) تظاهر می کنند . به هنگام برخاستن دام یا پس از انجام تمرینات ، تنفس دشوار شده و صدای ناله قابل شنود است . به هنگام دقه در ناحیه ریوی صدای گنگ در بخش پائینی ریه قابل توجه می باشد . در گوساله ها تظاهرات ریوی عموماً مشهود نبوده و گوساله های مبتلا التهاب مفصلی به همراه تورم در مفاصل را نشان می دهند .


اساساً در گاوهای مبتلا نشانه های بالینی از نظر شدت متفاوت است ، از شکل فوق حاد تا حاد گرفته به اشکال مزمن و تحت بالینی قابل تقسیم می باشد . شکل فوق حاد : در این شکل از بیماری که عمومیت چندانی ندارد، نشانه های بالینی به سرعت ظاهر می شوند.معمولاً نشانه های آسیب شناسی با چسبندگی آشکار پرده های جنب که همراه با التهاب آبشامه ای تراوشی است مشخص می گردد. دامهای درگیر به این شکل بیماری با تظاهر نشانه های تنفسی معمول در عرض یک هفته تلف می شوند .گاهی نیز دام ممکن است بدون بروز هرگونه نشانه ای بجز تب تلف شود . شکل حاد : این شکل از عمومی ترین اشکال بیماری است . مراحل اولیه بیماری از هر نوع التهاب ریوی شدید توام با التهاب پرده های جنبی قابل تمیز نیست . در این حالت دام مبتلا پس از یک دوره نهفته 3تا6 هفته ای دچار یک تب ناگهانی می گردد (40 درجه سانتی گراد) ، میزان شیردهی کاهش یافته ، دام بی اشتها بوده و روند نشخوار قطع می گردد . دام مبتلا به شدت افسرده است بطوری که از گله جدا شده ویا پشت سر آن حرکت می کند . سرفه در آغاز بیماری تنها در هنگام تمرینات ایجاد شده و خشک است ولی با تدام روند بیماری مرطوب می شود. ترشحات چرکی یا موکوسی از بینی دیده می شود . درد در ناحیه سینه بارز است . گاوهای مبتلا رغبتی به حرکت نداشته و با دست های گشاد و آرنج به بیرون می ایستند . سرکشیده بوده و پشت حالت قوزکرده و کمانی دارد و دهان به منظور تنفس آسان باز می باشد و تنفس دهانی است . خون ریزی از بینی ممکن است دیده شود و گزارش هائی از اسهال نیز وجود دارد. در دام مبتلا عمل تنفس کم عمق ، سریع ، شکمی و توام با دندان قروچه های بازدمی است ، با پیشرفت بیماری حیوان نشانه های بروز درد در هنگام دم و باز دم خواهد داشت . عمل دقه درناحیه سینه همراه با درد می باشد .با معاینه شنودی ناحیه سینه ای در مراحل اولیه بیماری صداهای مالشی پرده های جنبی را می توان شنید و در مراحل انتهائی گنگی ، صداهای مایعات و صداهای ترکیدن حبابی غل غل کننده مرطوب قابل تشخیص است . گنگ بودن برخی از نواحی ریه در عمل دقه مشخص می شود. تورم آماسی بی ثباتی را در ناحیه گلو و غب غب می توان دید . در گوساله های تا 6 ماه سن علارغم وجود نشانه های معمول التهاب ریوی عامل بیماری در مفاصل موضعی شده و موجب التهاب مفصلی آشکاری می گردد ، این التهاب مفصلی را خصوصاً در مفاصل کارپ و تارس میتواند دید بطوری که مفاصل متورم و گرم می باشند .التهاب مفصلی در گوساله چنان درد ناک می شود که حیوان از خم کردن آن سرباز می زند . پیچیده شدن بیماری در گوساله می تواند شامل التهاب آندوکاردی دریچه های قلبی و التهاب عضله قلب باشد . برخی از گاوهای آبستن دچار سقط شده و یا مرده زائی دارند . این شکل از بیماری غالباً کشنده بوده و دامهائی که زنده مانده اند دارای دوره نقاهتی طولانی مدت خواهند بود . در موارد ی که تلفات دیده می شود مرگ 2 تا 5 هفته پس از بروز نشانه های بالینی محقق می گردد . اشکال مزمن و تحت بالینی: در شکل تحت بالینی نشانه های بیماری ممکن است تنها محدود به وجود سرفه های مختصردر هنگام تمرین باشد یا اصلاً نشانه ای دیده نشود . بروز بیماری در اروپا بی شباهت به آنچه که در آفریقا دیده می شود از میزان شیوع و تلفات کمتری برخوردار است و بخش اعظم گاوهای مبتلا ضایعات مزمن نشان می دهند .گاوهائی که به این شکل از بیماری مبتلا هستند بعنوان ناقل بوده و جرم بیماری زا را بطور مستمر در محیط منتشر می کنند . دامهایی که این شکل تحت بالینی را دارند معمولاً برای چندین سال زنده مانده ولی با بروز هر نوع استرسی امکان گسترش بیماری و بروز شکل حاد وجود دارد . در موارد مزمن بیماری تب های راجعه وجود داشته ، تناسب پیکری دام رو به لاغری است و نشانه های تنفسی تنها ممکن است در موارد تمرین قابل مشاهده باشد . در منطقه ای که بیماری ناشناخته بوده و گزارش مبنی بر تائید آن وجود نداشته تشخیص قطعی و تائید یک همه گیری با مجموعه ای از عوامل تشخیصی به قطعیت می رسد که عبارتند از :1) نتیجه مثبت سرم شناسی ،2) مشاهده ضایعات مشخصه بیماری ، 3) جداسازی و تعین Mmymysc . جدا سازی و تائید این سویه(زیست گونه گاوی) از اساسی ترین ضروریات تائیدی این بیماری در مناطق با سابقه عاری از بیماری است . ولی در نواحی که بیماری قبلاً دیده شده تشخیص قطعی مبتنی بر نشانه های بالینی و کالبد گشائی ، مرور تاریخچه گله و بررسی های پس از مرگ شامل ارسال نمونه ها جهت تشخیص آزمایشگاهی است .
تشخیص آزمایشگاهی:
تشخیص آزمایشگاهی با استفاده از روش های آسیب شناسی بافتی ، تعین میکروب در مایع جنبی با استفاده از میکروسکوپ زمینه تاریک، جداسازی میکروب از مایعات جنبی یا ریوی و یا نشان دادن پادگن مختص میکروبی دربافت های ریوی با استفاده از روشهای ایمنی شناسی(مهار رشد ، انتشار ایمنی ، درخشندگی ایمنی ،اتصال ایمنی نقطه ای بر روی غشای پالایشی[MF-dot] یا سرم بسیار ایمن ضد گالاکتان) امکان پذیر است . اساساً تشخیص های سرم شناختی را در سطح گله برای برنامه های غربالگری و ریشه کنی اجرا می کنند و در موارد تشخیص انفرادی کشت میکروبی ارجحیت دارد . دامها ممکن است در مراحل اولیه بیماری تیتر های پادتنی قابل اندازه گیری نداشته باشند و تعدادی از دام ها نیز که به شکل مزمن بیماری هستند از نظر سرمی مثبت باشند. واکنش های مثبت کاذب نیز ممکن است در صورت دیگر عفونت های مایکوپلاسمائی حاصل آید . موارد تحت بالینی بیماری را می توان با استفاده از روش ثبوت مکمل تشخیص داد . در واقع آزمون ثبوت مکمل بر روی نمونه های سرمی از سودمند ترین شیوه های تشخیصی در تائید بیماری است . این آزمون در نسبت اندکی از دامهای تحت آزمون ممکن است نتایج کاذب داشته باشد . در مراحل اولیه بیماری ممکن است برخی واکنش منفی داشته(منفی کاذب) و در مواردی نیز که واکنش مثبت داشته اند در کالبد گشائی هیچ نوع ضایعه ای نداشته باشند(مثبت کاذب) . این آزمون در تعین دامهای ناقل مفید است . دامهائی که پس از ابتلاء به بیماری بهبود یافته اند منفی بوده و آنهائی که واکسن دریافت کرده اند تا حدود 6 هفته واکنش مثبت خواهند داشت.آزمون تعلیق بروی اسلاید شیشه ای وترسیب سریع بروی اسلاید شیشه ای(SAT) نیز در تشخیص بیماری قابل استفاده هستند ولی حساسیت این آزمون ها در مقایسه با ثبوت مکمل کمتر است . آزمون SAT را می توان بر روی خون تام یا سرم دام در یک گله اجرای نمود این آمون نسبتاً غیر حساس بوده و تنها می تواند دام مبتلا در مرحله حاد را تعین نماید. بنابر این توصیه می شود در تشخیص های گله ای از آزمونهای اخیر و در تشخیص انفرادی از آزمون ثبوت مکمل در کنار کشت میکروبی بهره جست . آزمون ثبوت مکمل تغییر یافته ای نیز وجود دارد که بنام ثبوت مکمل صفحه ای معروف است . آزمون فوق دقت بیشتری داشته و بسیار اقتصادی تر است . البته بایستی توجه داشت که علارغم دقت در هر آزمونی هرچه زمان نمونه گیری از زمان بروز نشانه های بالینی فاصله داشته باشد ازمیزان قابلیت اطمینان آزمون کاسته می شود . آزمون دیگرمبنی بررسوب پادگنی تدوین گردیده بنام آزمون ترسیبی لاتکس(LAT) . در این شگرد ریز حبابچه های لاتکس با گلوبولین های ایمن پلی کلونال MmmSC پوشیده شده و پادگن های این زیست گونه گاوی رادر سرم گاوهای آلوده و در محیط گشت حاوی MmmSC تشخیص می دهند . اصلی ترین پادگن قابل تعین در این شیوه تشخیصی کپسول پلی ساکاریدی این ریزجاندار بیماری زا است . همچنین از روش الیزا یا انتشار ایمنی در ژل آگار برای تعین حضور پادگن میکروبی در بافت ها نیز می توان استفاده کرد . با روش های کشت میکروبی و روش های تعین اسید های هسته ای می توان مایکوپلاسمای عامل التهاب ریه و پرده جنبی بز سانان را از این بیماری(CBPP) تمیز داد .اگرچه پادگن یا اسید های هسته ای میکروب در مواردی ممکن است از نمونه هائی که به لحاظ کشت میکروبی منفی هستند قابل تشخیص باشند- بعنوان مثال جداسازی پادگن از نمونه غدد لنفاوی بسیار موفقیت آمیز تر از کشت میکروبی است، ولی از طرفی این زیست گونه گاوی با بسیاری از گونه های مایکوپلاسمائی دارای واکنش متقاطع در آزمون های سرم شناسی بوده و قرابت ها بیوشیمیائی و ژنتیکی نیز دارد که موجب تداخل در امر تشخیص این بیماری می گردد. بنابر این تشخیص قطعی زمانی میسر می شود که این زیست گونه گاوی را از دام مبتلا جدا نمود . کشت میکروبی را می توان بر روی محیط های کشت استاندارد مایکوپلاسما انجام داد. پرکنه های این ریزجاندار بیماری زا کوچک بوده(درحدود 1 میلیمتر قطر دارند) و دارای ظاهری مایکوپلاسمائی چون تخم مرغ نیمروه شده است . رشد این پرکنه ها چند روزی بدراز می کشد . شیوه تشخیص اسید های هسته ای شامل واکنش پلیمریزاسیون زنجیری(PCR) است که در تعین میکروب در محیط های کشت کاربرد دارد . همچنین از این روش می توان برای تعین حضور میکروب در بافت ها ، ادرار یا خون بهره جست . پیش از اقدام به نمونه گیری یا ارسال نمونه از دامهای مشکوک به بیماری بایستی سازمان دامپزشکی را از این امر مطلع ساخت . ترشحات یا سوآپ های بینی ، مایعات بدست آمده از آلوئل ها و حبابچه های ریوی ، مایع شستشویافته از نای ، مایع جنبی از دام زنده اخذ می گردند. این نمونه ها به منظور کشت ، تعین پادگن و یا PCR قابل استفاده هستند. میکروب را ممکن است از خون نیز جدا کرد .در کالبد گشائی نمونه ها بایستی از ضایعات ریوی ، مایع جنبی و غددلنفاوی نواحی مجرای تنفسی برداشت شوند . نمونه های مربوط به ضایعات بافتی را بایستی از فصل مشترک بافت سالم و بیمار جدا نمود . در گوساله های دچار ورم مفصلی از مایع مفصلی می توان نمونه برداری نمود . در مواردی میکروب را می توان از کلیه ها جدا کرد . نمونه هایی که به منظور کشت ارسال می گردند بایستی در محیط کشت انتقالی و محفوظ جهت مراقبت از رشد دیگر باکتری ها قرار گیرند . این نمونه ها باید دردمای 4 درجه سانتی گراد ارسال شوند . در صورتی که مدت زمان ارسال بیش از چند روز است می توان نمونه ها را در دمای زیر 20- درجه سنتی گراد یا منجمد شده ارسال کرد . در صورت ممکن نمونه های سرمی بهتر است که دو عدد باشند یکی در مرحله حاد و دیگری مرحله نقاهت اخذ شوند.
یافته های کالبد گشائی:
ضایعات کالبد گشائی محدود به قفسه صدری بوده و غالباً یک طرفی هستند ،گاهی قسمت های مختلفی از هردو بخش ریه درگیر می شوند.قطعچه های در گیر مراحل متنوعی از کبدی شدن خاکستری و قرمز را نشان می دهند و فضاهای بین قطعچه ای با حضور ترشحات سروزی فیبرینی متسع می باشند، این تغییرات در برش مقطعی، به ریه ظاهری مرمری شکل میدهند.
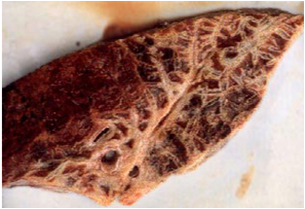
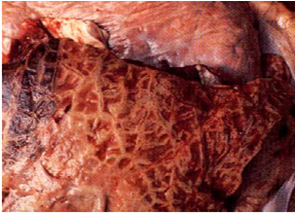
پرده جنبی غالباً ضخیم و ملتهب بوده که به همراه آن حجم وسیعی از فیبرین رسوب یافته و مقدار زیادی نشت سروزی روشن حاوی تکه های فیبرین دیده می شود . در شکل حاد بیماری مقدار معتنابهی از مایعات کاهی رنگ را می توان در حفره صدری و کیسه آب شامه مشاهده نمود . غدد لنفاوی در ناحیه سینه متورم و آماسی بوده و ممکن است دارای خون ریزی های سرسوزنی و کانون های کوچک نکروزه باشند . ریه ها سخت و نوعاً مرمری ، با نواحی متفاوت از نظر رنگ (صورتی کم رنگ، قرمز و تیره) بوده که توسط شبکه ای از نوار های بی رنگ تقسیم شده اند .تجمع گسترده ای از فیبرین را می توان بر سطوح پرده های جنب و در داخل تیغه های میان قطعچه ای یافت که موجب ضخیم شدن این تیغه های می گردند.
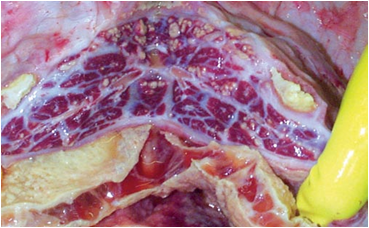
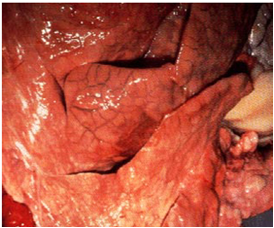
با گذشت زمان(پیشرفت بیماری) بافت همبندی فیبروزه جای گزین فیبرین می شود . در موارد مزمن بیماری تجمع مایعات دیده نمی شود ، اما چسبندگی پرده های جنبی در عمومیت وجود دارد . بافت های نکروزه در ریه کپسول دار شده ، تشکیل بافت های مرده ای را می دهند که در طی روند نکروز از بافت ریه جدا می شوند(سکاسترا) ، این بافت های مرده مجزا ممکن است حاوی ریزجاندار بیماری زای زنده باشند . بافت های مرده فوق 2 تا 25 سانتی متر قطر داشته و توسط کپسولی از بافت همبندی فیبروزه با ضخامتی تا حد 1 سانتی متر محصور شده اند . بافت های نکروزه در این بخش مرده بو نداشته و قادرند همچنانکه چروکیده و خشک می شوند ساختار قطعچه ای خود را حفظ نمایند ،اگر چه ممکن است بعداً آبگون گردند . گاهی این بخش های مرده بطور عمقی در ریه قرار داشته و علارغم اینکه دیده نمی شوند ولی قابل لمس هستند .

در گوساله های دارای التهاب مفصلی چندگانه ، مفاصل درگیر مملو از مایع و غنی از فیبرین می باشند . در طی همه گیری های جدیدی که در اروپا گزارش شده موارد درگیر ضایعات بارز کالبد گشایی نداشته اند .
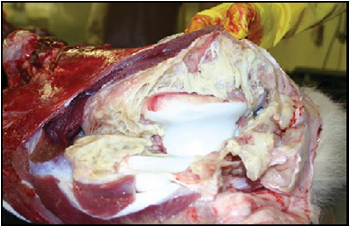
مشاهده قطعی ضایعات اختصاصی این بیماری از ضرویات مهم در تعین گاوهایی است که بطور تحت بالینی درگیرهستند.مراکز سازمان یافته مشهود در فضاهای بین قطعچه ای به همراه دیگر ضایعات یاد شده برای این بیماری به منزله ضایعات شاخص مرضی هستند . در موارد بهبود یافته بیماری برشهای دقیق ریوی به منظوربررسی وجود کانون و بافت نکروزه محصور در کپسول فیبرینی(سکاسترا) مورد نیاز است. وجود چسبندگی میان پرده های جنبی از یافته های ثابت در چنین مواردی است . در مواردی نیز ممکن است ضایعات آماسی در عقده های لنفی قفسه صدری یا لوزه ها دیده شود .
خلاصه ای از کالبد گشائی
- حضور میزان قابل توجهی از اکسودای زرد رنگ یا کدر در حفره صدری(تا 30 لیتر) که منعقد شده و تشکیل لخته های فیبرینی را می دهد .
- التهاب فیبرینی پرده جنب: التهاب و ضخیم شدن پرده جنب توام با رسوب فیبرین.
- آماس بین قطعچه ای ، ظاهری مرمری شکل به جهت کبدی شدن و تصلب در مراحل مختلف روند بیماری زائی که معمولاً محدود به یکی از ریه ها است .
- بافت های مرده چروکیده با کپسول فیبروزه محاط بر آن بافت های نکروزه خاکستری رنگ که در دام های بهبود یافته دیده می شود .
تشخیص تفریقی:
تشخیص تفریقی برای CBPP در شکل حاد آن شامل دیگر عوامل مسبب التهاب ریوی جنبی یا التهاب ریوی نایژکی است . این بیماریها عبارتند از : پاستورلوز(مانهایموز ) ، همچنین عفونت خونی منتشره منجر به خونریزی (سپتیسمی هموراژیک) ، تیلریوز(تب ساحل شرقی)، تب سه روزه ، طاعون گاوی و التهاب آب شامه ای ضربه ای . در خصوص شکل مزمن ریوی بایستی این بیماری را از کیست هیداتیت (اکینوکوکوزسی) ، آبسه های ریوی ، آکتینوباسیلوز، سل و سراجه(مشمشه) گاوی تمیز داد .
جنبه های بهداشت عمومی:
گونه انسانی نسبت به این نوع مایکوپلاسما(زیست گونه گاوی ) حساس نمی باشد .
درمان :
اعمال درمان تنها در مناطقی توصیه می شود که بیماری بصورت بومی منطقه است ولی در نواحی که بیماری جدیداً شیوع یافته انجام برنامه های ریشه کنی بر درمان ارجحیت دارد . ترکیبات پادزیستی سولفانیلامید ی و ترکیبات آرسینیکی عالی بطور گسترده مصرف می گردند و بنظر می آید که نقش خوبی در کاستن از تلفات دارند . پنیسیلین ها تاثیر اندکی دارند ، استرپتومایسین تاحدی اثرات درمان بخشی دارد ، اکسی تتراسیکلین و کلرآمفینیکول تاحدی موثر می باشند . استفاده از تایلوزین در کنترل واکنش های جانبی مایه کوبی و موارد بالینی با ارزش می باشد . تایلوزین با دوز 10 میلی گرم برای هر کیلوگرم وزن زنده دان ،دوبار در روز و در 6 بار تزریق بکار می رود .اریترو مایسین بر علیه برخی از مایکوپلاسماها موثر می باشد . اسپیرومایسین (با دوز 10 میلی گرم برای هر کیلوگرم وزن زنده دام تاحد 20 میلی گرم یا حتی 50 میلی گرم)در درمان موارد مبتلا با واکسن بسیار موثر می باشد . در موارد شدی بیماری ادامه درمان تا 3 روز توصیه می شود .
کنترل و پیشگیری:
اساسی ترین نیاز در برنامه های کنترلی بر علیه این بیماری داشتن آزمون های تشخیصی موثری است که بتواند ریزجاندار بیماری زای ((M. mycoides subsp. mycoides SC مسبب را نه تنها در حیوانات بیمار بلکه در دامهای بی نشان ناقل نیز شناسائی نماید . در کنار این آزمون ها برنامه های راهبردی مایه کوبی که قادر باشد فشار عفونت در مناطق آلوده را با پیشگیری از بروز عفونت ، تجمع و تکثیر در میزبان ها ، کاهش دهند . در حالت کلی برنامه های کنترلی را با توجه به وجود سابقه بیماری در منطقه(بومی منطقه) یا پاک بودن منطقه در دو سطح گله و منطقه طبقه بندی و مورد بحث قرار می دهیم. کنترل بیماری درسطح گله : با تثبیت بیماری در یک گله اقدامات اصلی در راستای کنترل و ممانعت از انتشارآن شامل اقدامات بهداشتی ، حذف منابع عفونت و مایه کوبی خواهد بود. به هر نحوی بایستی از تماس نزدیک دامها جلوگیری کرد(خصوصاً در مراحل اولیه شیوع) .انتشار عامل از طریق شیردوشی ، جمع آوری نمونه ، خون گیری و مایه کوبی تسهیل می گردد. این سهولت انتشار خصوصاً در شرایط محیطی مرطوب عملی تر است . بنابر این بایستی یک قرنطینه سخت را در مورد گله آلوده یا در معرض تماس اعمال نمود ه و آن را تا حذف تمامی دامهای مبتلا ادامه داد . معمولاً 12 هفته پس از حذف آخرین دام مبتلا این قرنطینه بایستی اجرای شود . در این مدت قرنطینه گله را بایستی در تحت یک پایش مداوم قرار داد تا اینکه موارد بالینی ظاهر شوند . با ظاهر شدن موارد ابتلاء حیوانات آلوده بایستی به سرعت از گله حذف شوند . با استفاده از آزمون ثبوت مکمل و ترجیحاً توام با معاینات بالینی می تواند موارد ابتلای را به طور موثری شناسائی نمود. از آن جهتی که دامهای مبتلا دردوره نهفته و مراحل اولیه بیماری نسبت به این آزمون منفی کاذب هستند، لذا زمانی می توان گله را از بیماری پاک شده تلقی نمود که نتایج دو مرحله آزمون در گله با فاصله 2 ماه منفی باشد . نکته قابل تامل در این رابطه دامهای مایه کوبی شده اند ، که می تواند نتایج مثبت کاذب را ایجاد کنند ولی معمولاً این نوع واکنش های مثبت در طی دو ماه ازبین رفته و در موارد نادر تا 5 ماه به درازا می کشند . تمامی موارد مثبت آزمون و موارد مشکوک به همراه دامهای دارای نشانه های بالینی بایستی از گله حذف و یا در تحت مراقبت ویژه وشدید به کشتارگاه ارسال شوند، این دامها در کشتارگاه نیز تا زمان کشتاربایستی درتحت قرنطیه باشند. انجام مایه کوبی یکی از راه های موثر در کنترل بیماری است . تمامی واکسن های مور استفاده زنده بوده و احتمال انتشار بیماری را همواره بایستی در صورت کاربرد آنها در نظر داشت . انجام مایه کوبی با سویه های تخفیف حدت یافته بعید است که موجب انتشار بیماری گردد ولی به دلیل وجود این احتمال، انجام مایه کوبی تنها در گله ها و یا مناطقی توصیه می شود که بیماری حضور داشته باشد(بومی منطقه) . ارزش مایه کوبی در گوساله ها محدود است چرا که کار برد واکسن در گوساله های کمتر از دو ماه همراه با واکنش های التهابی در مفاصل ، عضله قلبی و دریچه های قلبی در طی 3 تا 4 هفته بعد از مایه کوبی است . لذا انجام مایه کوبی در گوساله های بالای 2 ماه سن توصیه می شود . کنترل بیماری در سطح یک منطقه: اساساً عامل بیماری زا از طریق دامهای و یا جنین های آلوده قادرند که به یک منطقه عاری از بیماری وارد شوند. لذا اولین گام ممانعت از ورود ریزجاندار بیماری زا توسط ناقلین به منطقه است .پیشگیری از ورود عامل بیماری زا در این مورد به مناطق عاری از بیماری کار بسیار دشواری است . به این منظور تنها بایستی به گروهای ذیل اجازه ورود به منطقه داده شود . 1) گاوها ی که حداقل6ماه در مناطق آلوده نبوده و تماسی با حیوانات بیمار نداشته اند . 2) گاوهای که در طی دو مرحله آزمون ثبوت مکمل با فاصله دو ماه منفی بوده و در این مدت نیز تماسی با دامهای آلوده نداشته اند .البته ممکن است که این دامها تحت ماه کوبی قرار گرفته و یا اینکه واکسنی دریافت نکرده باشند . اما در صورتی که علارغم تمامی این اقدامات پیشگیرانه سخت بیماری وارد منطقه شده باشد دو راهکار کنترلی را می توان اعمال نمود : مایه کوبی و ریشه کنی بیماری بواسطه آزمون و کشتار موارد مثبت. انجام مایه کوبی در چنین شرایطی اولین قدم لازم در جهت کاهش میزان شیوع تا حدی است که بتوان برنامه های ریشه کنی را اجرای کرد .
